导读:
胰腺癌被称为“癌症之王”,早期症状不明显,发现后恶性程度极高,病程又非常快。这导致发现后即使治疗,预后结果也不理想。据中国国家癌症中心的数据,2019—2021年,中国所有癌症中,胰腺癌五年生存率最低,仅为8.5%。
随着新药研发加快,以及新的免疫激活策略和AI助力早期诊断,这一情况或得到改变。
Amber Dance | 撰文
莫喻枫 | 翻译
陈晓雪 | 编辑
被诊断出患胰腺癌,对患者而言无异于晴天霹雳。胰腺癌尽管在美国所有癌症中仅占约 3%,却是最致命的癌症之一,预计到 2030 年将成为美国致死人数第二高的癌症,仅次于肺癌 [1]。近年来,其他癌症的筛查和治疗手段突飞猛进,而胰腺癌却始终处于 “早筛难、治疗难” 的困境之中。
“不过,希望正在出现,” 美国加州埃尔塞贡多(El Segundo)的 “胰腺癌行动网络” 组织(Pancreatic Cancer Action Network)首席科学与医学官安娜·伯肯布利特(Anna Berkenblit)表示。目前,科学家们正测试一系列新药,有望精准靶向那些曾被认为无法成药的致癌因子;科学家也在 “训练” 患者自身的免疫系统,使其能够识别并攻击过去无法靠自身识别的肿瘤;此外,人工智能技术也被用于胰腺癌的早期诊断。
“我们的目标是将胰腺癌转变为一种可治愈的疾病,” 美国卢斯特加滕基金会(Lustgarten Foundation)负责胰腺癌科研事务的副总裁安德鲁·拉克曼(Andrew Rakeman)表示,“或者至少让它变成一种可以长期生存、可以管理、更像慢性病的状态。”
目前,胰腺癌的五年生存率仅为 13%,情况严峻。部分原因在于胰腺肿瘤周围包裹着致密、瘢痕样的组织,阻碍了药物和免疫细胞的进入。同时,小肿瘤发展迅速,往往在扩散前难以察觉 [2],等到被发现时,通常已错过手术完全切除的机会。
当前最有希望的药物之一,能够靶向一种名为 KRAS 的蛋白质。正常情况下,KRAS 参与调控细胞生长。但在超过 90% 的胰腺癌病例中,KRAS 的突变版本会持续处于激活状态,导致细胞不受控制地分裂。
癌症生物学家一直希望能遏制 KRAS 这台机器的运转,但长期以来苦于找不到合适的切入口。 “有人曾向我形容它就像一个又小又滑的球……表面根本没有可以让抑制剂嵌入的 ‘口袋’,” 美国冷泉港实验室(Cold Spring Harbor Laboratory)的癌症生物学家佩奇·弗格森(Paige Ferguson)说。她曾合著了一篇关于胰腺癌治疗挑战的综述文章,该文章发表于《2025 年癌症生物学年度综述》(Annual Review of Cancer Biology)[3]。
于是,研究人员另辟蹊径:他们设计出一种药物,通过结合另一种蛋白形成药物-蛋白复合物,随后复合物能 “抓住” KRAS,从而抑制其作恶。在一项早期临床试验中,38 名接受该药物(daraxonrasib)治疗的胰腺癌患者的中位无进展生存期超过了 8 个月 [4]。同时,患者血液中的循环肿瘤 DNA(ctDNA)水平也明显下降 [5]。
研发该药物的 Revolution Medicines 公司,位于美国加州的雷德伍德城(Redwood City),正在开展更大规模的临床试验 [6],结果预计将于 2026 年年中公布。美国食品药品监督管理局(FDA)已给予该药快速审评通道资格 [7]。
疫苗带来新的希望
另一个备受关注的方向是疫苗。这类治疗性疫苗不同于预防感染的常规疫苗,它们一般被用于已经患癌的患者,目的是训练患者的免疫系统清除现有的或复发的肿瘤细胞 [8]。
与常规疫苗类似,癌症疫苗会提供一种被人体免疫系统视为 “外来且有害” 的分子。癌症疫苗会提供由癌细胞产生的分子,因此免疫系统会针对性地攻击癌细胞。FDA 早在 2010 年就批准了首个治疗性癌症疫苗(用于前列腺癌)[9],目前针对其他癌症的疫苗也正在测试中 [10]。
然而,胰腺癌对激活患者免疫系统的疗法表现出极强的抵抗力。“它有一种惊人的能力,能把免疫系统挡在外面,并告诉免疫系统别管它,” 安德鲁·拉克曼说。
美国 MD 安德森癌症中心(MD Anderson Cancer Center)的肿瘤内科医生舒巴姆·潘特(Shubham Pant)解释说,部分原因在于肿瘤周围致密的组织 “像一座堡垒”。但如果这些致密组织连同内部的肿瘤都被手术切除,那么残留的少量癌细胞就失去了保护。潘特及其同事推断,术后使用疫苗或许能刺激免疫系统清除这些残余癌细胞。
科学家们与美国波士顿的 Elicio Therapeutics 公司合作,测试了一种包含两种突变型 KRAS 蛋白片段的疫苗,希望借此训练免疫系统识别并攻击携带这些突变的癌细胞。
研究团队开展了一项小型癌症疫苗临床试验,共纳入 20 名胰腺癌患者和 5 名结直肠癌患者。在接受肿瘤切除手术后,21 名患者体内产生了能够有效识别并攻击自身癌细胞的 T 细胞 [11]。潘特表示,其中17 名患者表现出较强的免疫反应,其血液中循环肿瘤 DNA(ctDNA)水平显著降低;尤为引人注目的是,这 17 人中有 13 人自首次接种疫苗以来已生存超过三年。
受此鼓舞,研究团队进一步开发了一种可覆盖全部七种常见 KRAS 突变的广谱疫苗。目前,他们正在 158 名患者中进行更大规模的临床试验 [12]。
美国纪念斯隆-凯特琳癌症中心(Memorial Sloan Kettering Cancer Center)则测试了另一种类型的疫苗。该中心 Olayan 癌症疫苗中心主任、外科医生兼科学家维诺德·巴拉钱德兰(Vinod Balachandran)指出,能存活超过五年的胰腺癌患者极少,不到总患者数的十分之一。研究发现,这些幸存者确实对自身癌症产生了免疫反应,但他们的免疫细胞并非针对突变的 KRAS [13],而是针对癌细胞因 DNA 复制错误而产生的其他异常蛋白。当这些突变蛋白出现在癌细胞表面时,就会成为免疫系统的 “警报”。
巴拉钱德兰希望让更多胰腺癌患者也能触发这种免疫反应。因此,他与同事为试验参与者提供了个性化定制疫苗——由德国 BioNTech 公司和美国基因泰克(Genentech)公司联合开发,疫苗根据每位患者特有的突变蛋白来设计。
在早期试验中,16 名患者中有 8 人接种后产生了针对突变蛋白的 T 细胞 [14],且这些 T 细胞持续存在好几年 [15]。产生免疫应答的患者癌症复发时间明显晚于无免疫应答者,且这 8 名产生免疫应答的患者在接受治疗后均存活至少两年。目前,一项更大规模的国际多中心临床试验正在进行中。
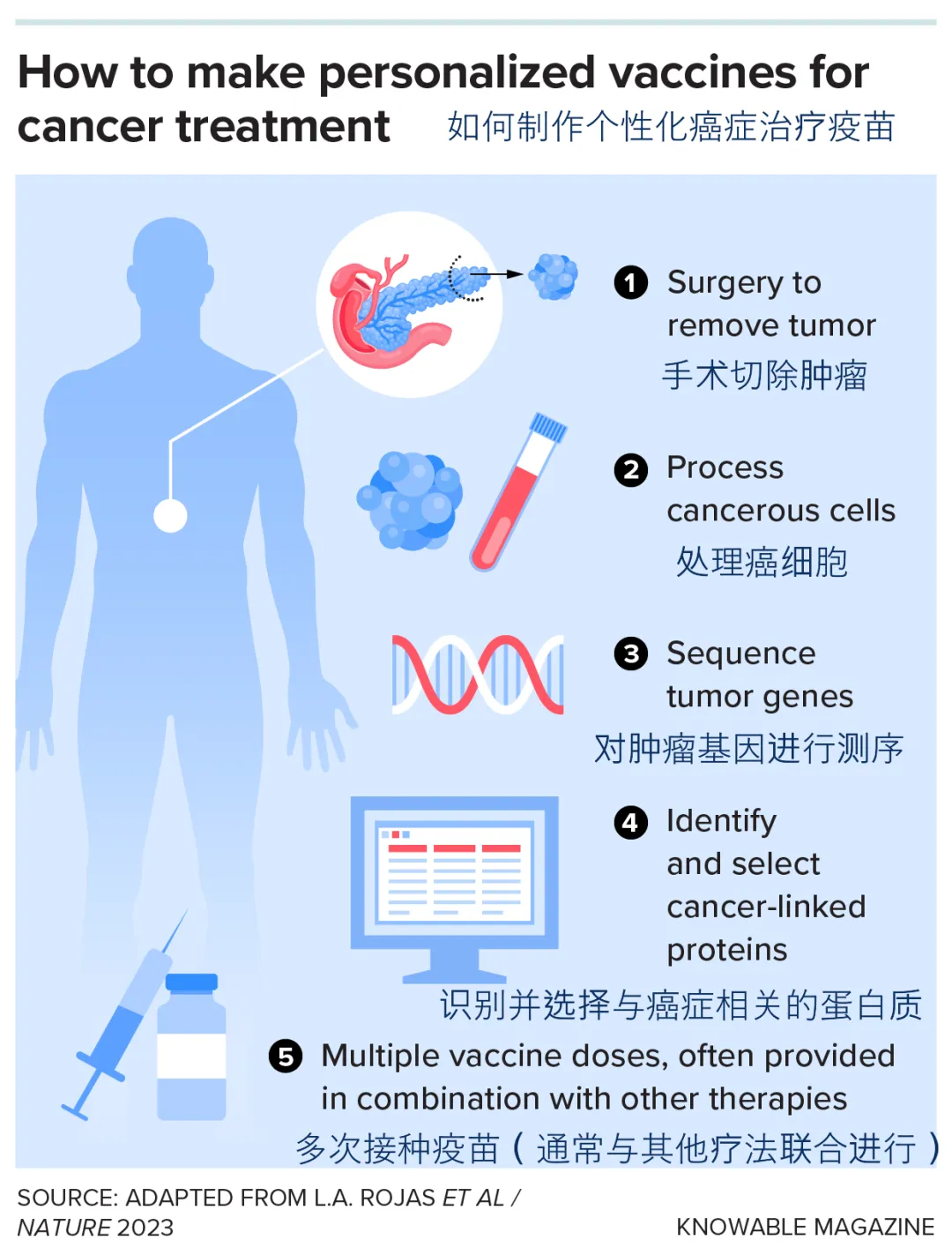
治疗性癌症疫苗基于每位患者肿瘤特有的突变。在肿瘤被切除后,科学家会收集肿瘤细胞并分析其基因突变,然后根据这些突变信息定制个性化的疫苗。
早期诊断的推进
在癌症扩散前及时诊断并手术切除肿瘤,是遏制胰腺癌的另一关键策略。
美国加州门洛帕克(Menlo Park)的 GRAIL 等诊断公司通过在血液中检测筛查肿瘤 DNA,正在实现包括胰腺癌在内的多种癌症的早期发现。2025 年 10 月,在欧洲肿瘤内科学会(ESMO)大会上,GRAIL 公布了最新成果 [16]:在 23161 名 50 岁以上、近期无癌症史且随访至少一年的人群中,该检测工具成功识别出了 133 例后来被确诊为癌症(包括胰腺癌)的个体 [17]。其中约一半的确诊病例处于早期阶段。
但他们的检测工具也会出错:有 83 人被误判为患癌(假阳性)。佩奇·弗格森指出,即使是非常优秀的检测方法也会出现假阳性,而由于胰腺癌本身发病率较低,若在普通人群中广泛筛查,将产生大量误报。因此,许多医生倾向于仅对高风险人群进行筛查。
美国约翰·霍普金斯医学院(Johns Hopkins Medicine)的胃肠病学与胰腺病学专家文卡塔·阿克辛塔拉(Venkata Akshintala)表示,高风险人群包括患有胰腺囊肿等异常病变者、携带癌症相关基因突变者,以及有胰腺癌家族史者。他参与了在约翰·霍普金斯及其他临床中心长期开展的 “胰腺癌筛查研究”(CAPS),该研究旨在通过 DNA 检测、胰液分析或影像学检查,在高风险人群中识别早期癌变迹象。
筛查似乎卓有成效。“我们通常能在早期阶段就发现癌症,” 阿克辛塔拉说。在 1731 名参与者中,有 19 人在监测期间被诊断出癌症。研究人员在 2022 年报告称,这些患者的平均生存期接近十年 [18],而未接受监测的患者在确诊后平均仅存活 1.5 年。
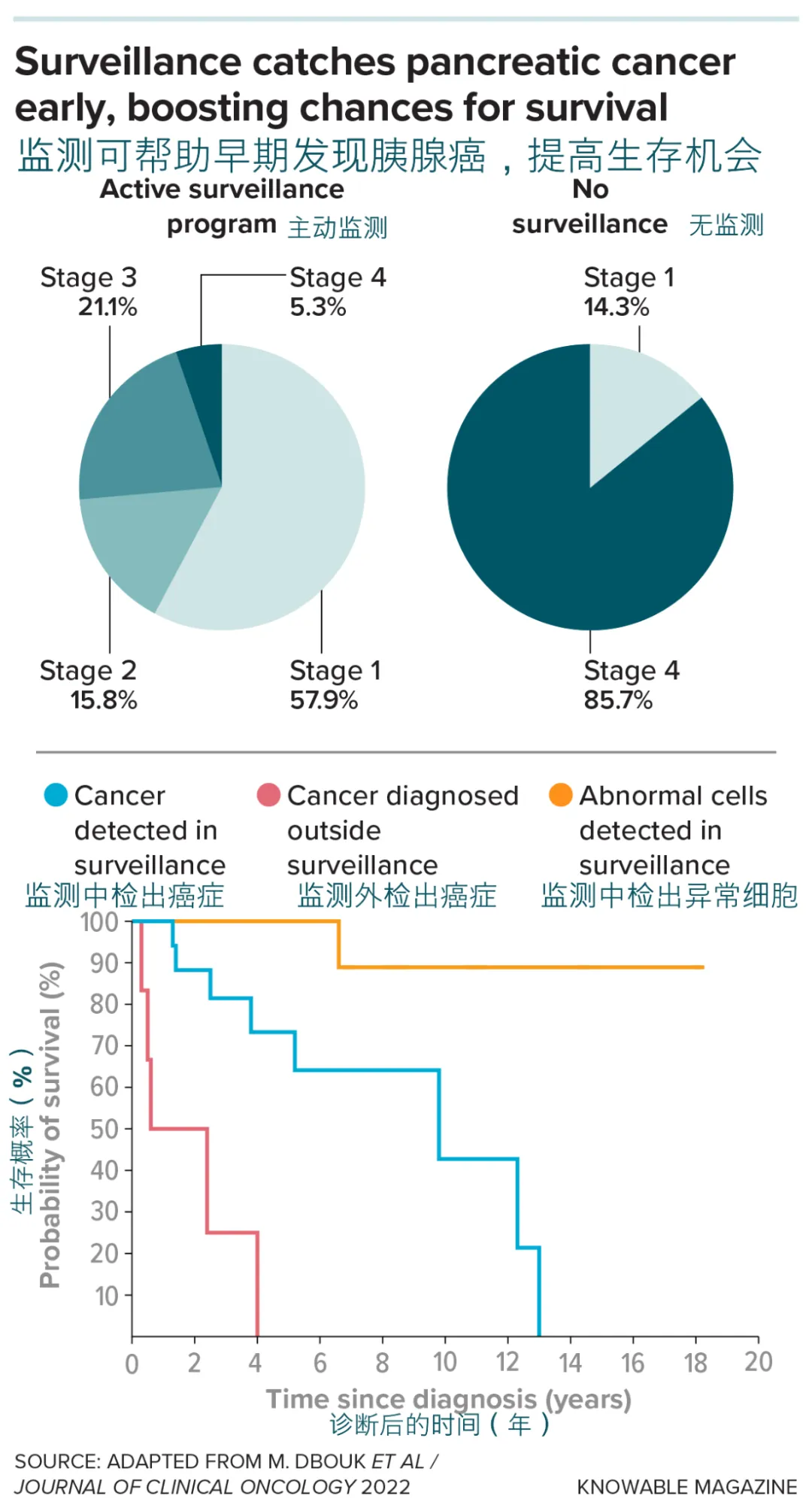
参加CAPS监测项目的胰腺癌患者,通常比未参与主动监测项目的人群在更早的疾病阶段获得诊断(上)。此外,在监测项目中检出癌症或异常细胞的患者,其生存概率也高于在项目外被诊断的患者(下)。
约翰·霍普金斯的研究人员认为,还可以借助人工智能(AI)进一步提升筛查效果。胃肠病专家(如阿克辛塔拉)常通过内镜超声图像(黑白、斑驳状)寻找早期病变迹象,而 AI 可帮助识别其中与胰腺癌相关的模式。研究团队在 2024 年 “消化疾病周”(Digestive Disease Week)会议上报告称,将 AI 与医生的专业判断相结合,比单独使用任何一种方法都能更准确地预测癌症进展 [19]。
与此同时,在 MD 安德森癌症中心,胃肠病学家苏雷什·查里(Suresh Chari)正在研究另一个有望用于早期诊断的线索:血糖检测结果呈现类似 2 型糖尿病的特征,并伴随意外体重减轻很可能是一个胰腺癌早期的征兆。通常,胰腺通过释放激素调节血糖;但在这种情况下,“是胰腺癌在导致你的葡萄糖代谢失控,” 查里解释道。
在一项基于医疗记录的研究中,查里及其同事开发了一种风险评分模型,综合评估患者的血糖波动与体重减轻情况。研究结果显示,在 9 名后续被确诊为胰腺癌的患者中,该模型成功识别出其中 7 人 [20]。查里指出,尽管大多数高风险评分者最终并未罹患胰腺癌,但这一筛查工具有助于有效缩小需进一步检查的目标人群范围。基于这项研究成果,他计划启动一项临床试验:对高风险评分者在其血糖检测结果出具后的 15 天内,安排一次由人工智能辅助的 CT 扫描。
这些正在研发中的早期检测手段与新型治疗方法预示着,胰腺癌或许终将不再是最致命的癌症之一。
“在未来10年内,” 安娜·伯肯布利特表示,“我相信我们将见证患者生存率的显著提升。”
原文标题Progress fighting pancreatic cancer — one of the deadliest malignancies,2025年12月11日发表于Knowable Magazine,《赛先生》获授权翻译并发布。
原文链接:
https://knowablemagazine.org/content/article/health-disease/2025/progress-for-pancreatic-cancer
版权声明:
本文授权翻译自Annual Reviews 旗下杂志 Knowable Magazine,点击文末阅读原文可订阅其英文通讯。Annual Reviews是一家致力于向科研工作者们提供高度概括、综合信息的非营利性机构,且专注于出版综述期刊。Annual Reviews官方中文微信公众号已经上线,欢迎关注。
参考文献:
[1] Rahib, Lola, et al. "Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States." Cancer research 74.11 (2014): 2913-2921.
[2] https://knowablemagazine.org/content/article/health-disease/2025/how-cancer-cells-metastasize
[3] Ferguson, L. Paige, and David A. Tuveson. "Road Map to Defeat Pancreatic Cancer." Annual Review of Cancer Biology 9.1 (2025): 1-20.
[4] https://ir.revmed.com/news-releases/news-release-details/revolution-medicines-shares-new-clinical-results-supporting
[5] Garrido-Laguna, Ignacio, et al. "Safety, efficacy, and on-treatment circulating tumor DNA (ctDNA) changes from a phase 1 study of RMC-6236, a RAS (ON) multi-selective, tri-complex inhibitor, in patients with RAS mutant pancreatic ductal adenocarcinoma (PDAC)." (2025): 722-722.
[6] https://www.clinicaltrials.gov/study/NCT06625320
[7] https://www.washingtonpost.com/health/2025/11/05/cancer-pancreatic-drug-fda-trump/
[8] https://knowablemagazine.org/content/article/technology/2023/after-covid19-mrna-vaccines-for-cancer-too
[9] Cheever, Martin A., and Celestia S. Higano. "PROVENGE (Sipuleucel-T) in prostate cancer: the first FDA-approved therapeutic cancer vaccine." Clinical Cancer Research 17.11 (2011): 3520-3526.
[10] Zhou, Yingqiong, et al. "Cancer vaccines: current status and future directions." Journal of Hematology & Oncology 18.1 (2025): 18.
[11] Pant, Shubham, et al. "Lymph-node-targeted, mKRAS-specific amphiphile vaccine in pancreatic and colorectal cancer: the phase 1 AMPLIFY-201 trial." Nature medicine 30.2 (2024): 531-542.
[12] https://clinicaltrials.gov/study/NCT05726864
[13] Balachandran, Vinod P., et al. "Identification of unique neoantigen qualities in long-term survivors of pancreatic cancer." Nature 551.7681 (2017): 512-516.
[14] Rojas, Luis A., et al. "Personalized RNA neoantigen vaccines stimulate T cells in pancreatic cancer." Nature 618.7963 (2023): 144-150.
[15] Sethna, Zachary, et al. "RNA neoantigen vaccines prime long-lived CD8+ T cells in pancreatic cancer." Nature (2025): 1-10.
[16] https://grail.com/press-releases/grail-pathfinder-2-results-show-galleri-multi-cancer-early-detection-blood-test-increased-cancer-detection-more-than-seven-fold-when-added-to-uspstf-a-and-b-recommended-screenings/
[17] https://www.statnews.com/2025/10/17/grail-galleri-blood-test-cancer-screening-study-results-2025/
[18] Dbouk, Mohamad, et al. "The multicenter cancer of pancreas screening study: impact on stage and survival." Journal of clinical oncology 40.28 (2022): 3257-3266.
[19] https://ddw.digitellinc.com/p/s/machine-learning-analysis-of-endoscopic-ultrasonography-texture-and-clinical-information-predicts-pancreatic-neoplastic-progression-in-high-risk-individuals-within-18-months-5579
[20] Sharma, Ayush, et al. "Model to determine risk of pancreatic cancer in patients with new-onset diabetes." Gastroenterology 155.3 (2018): 730-739.
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 